1. Teori Domain Elektron
Teori domain elektron adalah suatu cara meramalkan bentuk molekul bentuk molekul berdasarkan tolak menolak elektron-elektron pada kulit luar atom pusat. Teori ini merupakan penyempurnaan dari teori VSEPR (valence shell electron pair repulsion). Domain elektron berarti kedudukan elektron atau daerah keberadaan elektron. Jumlah domain elektron ditentukan sebagai berikut :
- Setiap elektron ikatan (apakah ikatan tunggal, rangkap, atau rangkap tiga) berarti 1 domain.
- Setiap pasangan elektron bebas berarti 1 domain.
Prinsip-prinsip dasar teori domain elektron adalah sebagai berikut :
- Antar domain elektron pada kulit luar atom pusat saling tolak menolak sehingga domain elektron akan mengatur diri (mengambil formasi) sedemikian rupa sehingga tolak menolak di antaranya menjadi minimum.
- Urutan kekuatan tolak menolak di antara domain elektron adalah sebagai berikut: Tolakan antardomain elektron bebas > tolakan antardomain elektron bebas dengan domain elektron ikatan > tolakan antardomain elektron ikatan. Perbedaan daya tolak ini terjadi karena pasangan elektron bebas hanya terikat pada satu atom saja, sehingga bergerak lebih leluasa dan menempati ruang lebih besar daripada pasangan elektron ikatan. Akibat dari perbedaan daya tolak tersebut adalah mengecilnya sudut ikatan karena desakan dari pasangan elektron bebas.
- Bentuk molekul hanya ditentukan oleh pasangan elektron terikat.
Gambar Geometri molekul
Tabel : Susunan ruang domain elektron yang menghasilkan tolakan minimum
Jumlahdomain elektron
Susunan ruang(geometri)
Besar sudut
ikatan
2
Linear
180°
3
Segitiga sama sisi
120°
4
Tetrahedron
109,5°
5
Bipiramida trigonal
Ekuatorial=120° Aksial=90°
6
Oktahedron
90°
2. Merumuskan Tipe MolekulJumlah domain (pasangan elektron) dalam suatu molekul, dapat dinyatakan sebagai berikut :
- Atom pusat dinyatakan dengan lambing A,
- Domain elektron ikatan dinyatakan dengan X, dan
- Domain elektron bebas dinyatakan dengan E
Tabel : Berbagai kemungkinan bentuk molekul yang atom pusatnya mempunyai 4, 5, atau 6 pasangan elektron
Jumlah PEI
Jumlah PEB
Rumus
Bentuk molekul
Contoh
4
0
AX4
Tetrahedron
CH4
3
1
AX3E
Piramida trigonal
NH3
2
2
AX2E2
Planar bentuk V
H2O
5
0
AX5
Bipiramida trigonal
PCl5
4
1
AX4E
Bidang empat
SF4
3
2
AX3E2
Planar bentuk T
IF3
2
3
AX2E3
Linear
XeF2
6
0
AX6
Oktahedron
SF6
5
1
AX5E
Piramida sisiempat
IF5
4
2
AX4E2
Segiempat planar
XeF4
Tipe molekul dapat ditentukan dengan langkah-langkah sebagai berikut:
- Tentukan jumlah elektron valensi atom pusat (EV)
- Tentukan jumlah domain elektron ikatan (X)
- Tentukan jumlah domain elektron bebas (E)
Cara penetapan tipe molekul tersebut hanya berlaku untuk senyawa biner berikatan tunggal. Untuk senyawa biner yang berikatan rangkap atau ikatan kovalen koordinat (misalnya dengan oksigen), maka jumlah elektron yang digunakan untuk membentuk pasangan terikat menjadi 2 kali jumlah ikatan. Selanjutnya, langkah-langkah untuk meramalkan geometri adalah sebagai berikut :
- Menentukan tipe molekul
- Menggambar susunan ruang domain-domain elektron di sekitar atom pusat yang memberi tolakan minimum.
- Menetapkan pasangan terikat dengan menuliskan lambing atom yang bersangkutan.
- Menentukan geometri molekul setelah mempertimbangkan pasangan elektron bebas.
3. Molekul polar dan nonpolarSuatu molekul akan bersifat polar jika memenuhi 2 syarat nerikut :
- Ikatan dalam molekul bersifat polar. Secara umum, ikatan antaratom yang berbeda dapat dianggap polar.
- Bentuk molekul tidak simetris, sehingga pusat muatan positif tidak berimpit dengan pusat muatan negatif.
Latihan 3.1 Materi Ikatan Kimia
SOAL NO 1
Bagaimana kecenderungan atom-atom berikut ini dalam mencapai kestabilan, jika
ditinjau dari konfigurasi elektronnya?
a.6C
b.9F
c.19K
d.16S
e.13Al
PEMBAHASAN
Latihan 3.2 Materi Ikatan Kimia
SOAL NO 1
jelaskan pengertian ikatan ion
PEMBAHASAN
Ikatan yang terjadi karena adanya gaya tarik-menarik elektrostatis antara ion postif
dengan ion negatif. Atau ikatan yang terjadi antara logam (melepas elektron) dengan
non logam (menangkap elektron)
SOAL NO 2
Unsur-unsur logam bila bersenyawa dengan unsur-unsur non logam mempunyai
kecenderungan untuk membentuk ikatan ion. Bagaimana pendapat Anda tentang
pernyataan ini? Jelaskan
PEMBAHASAN
Unsur logam untuk mencapai kestabilan akan melepaskan elektron valensinya
membentuk ion positif sedangkan unsur non logam mencapai kestabilan dengan
menangkap elektron membentuk ion negatif. Ion positif dan ion negatif akan terjadi
gaya tarik menarik elektrostatik yang kemudian disebut ikatan ion
SOAL NO 3
Jelaskan terjadinya ikatan ion pada senyawa berikut :
a. K2S (nomor atom K = 19 dan S = 16)
b. MgF2 (nomor atom Mg = 12 dan F = 9)
PEMBAHASAN
SOAL NO 4
Mengapa kristal senyawa ion dapat pecah jika dikenai tekanan (dipukul)?
PEMBAHASAN
Apabila senyawa ion dipukul, akan terjadi pergeseran posisi ion positif dan negatif,
dari yang semula berselang-seling menjadi berhadapan langsung. Hal ini
menyebabkan ion positif bertemu muka dengan ion positif dan terjadi gaya tolak-
menolak. Hal ini yang menyebabkan senyawa ion bersifat rapuh.
Saran Artikel : Rangkuman Lengkap Ikatan Kimia
Latihan 3.3 Materi Ikatan Kimia
SOAL NO 1
Gambarkan rumus titik elektron (struktur Lewis) dari molekul-molekul di bawah ini:
a. Cl2O
b. NCL3
c. P2O3
d. H3PO4
e. HNO3
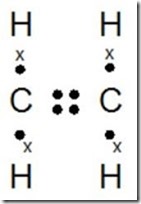
f. CH4
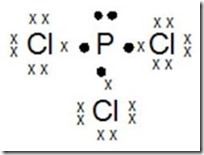
g. PCl3
h. CO2
i. SiF4
PEMBAHASAN
a. Cl2O
b. NCL3
c. P2O3
d. H3PO4
e. HNO3
f. CH4
g. PCl3
h. CO2
i. SiF4
SOAL NO 2
Atom S (nomor atom 16) bergabung dengan atom Cl (nomor atom 17) membentuk
molekul SCl2
a. Gambarkan rumus titik elektron dari molekul SCl2
b. Tentukan berapa jumlah pasangan elektron ikatan dan elektron bebas di
sekitar atom pusat (S).
PEMBAHASAN
SOAL NO 3
Atom 6C dan 1H dapat membentuk molekul C2H2, C2H4, dan C2H6
a. Gambarkan rumus titik elektron untuk ketiga molekul tersebut
b. Di antara ketiga molekul tersebut, molekul mana saja yang mempunyai ikatan tunggal, ikatan rangkap dua, dan ikatan rangkap tiga?
PEMBAHASAN
a. 6C : 2 4 (menangkap 4e
1H : 1 (menangkap 1e)
b. Yang memiliki ikatan tunggal : C2H6
Ikatan rangkap 2 : C2H4
Ikatan rangkap 3 : C2H2
SOAL NO 4
Jelaskan terjadinya ikatan pada molekul PCl3 dengan menggunakan struktur Lewis
dan tentukan jumlah pasangan elektron ikatan dan pasangan elektron bebasnya.
PEMBAHASAN
15P : 2 8 5 (menangkap 3e)
17Cl : 2 8 7 (menangkap 1e)
Jumlah pasangan elektron ikatan : 3
Jumlah Pasangan elektron bebas : 1
SOAL NO 5
Ikatan apa saja yang terdapat dalam senyawa KClO3?
PEMBAHASAN
Terjadi ikatan ionik antara K+ dan ClO3- dan terjadi ikatan kovalen didalam ion ClO3-
Latihan 3.4 Materi Ikatan Kimia
SOAL NO 1
Jelaskan dengan singkat mengapa logam dapat menghantar listrik dengan baik
PEMBAHASAN
Adanya elektron yang dapat bergerak bebas dari satu atom ke atom yang lain
SOAL NO 2
Mengapa logam bersifat ulet, mudah ditempa, dan mudah dibuat menjadi kawat?
PEMBAHASAN
Lautan elektron pada kristal logam memegang erat ion-ion pada logam sehingga bila
dipukul atau ditempa, logam tidak akan pecah atau tercerai berai, tetapi akan
bergeser.
SOAL NO 3
Kristal senyawa ion yang dikenai tekanan (dipukul) akan pecah sedangkan kristal
logam tidak, jelaskan mengapa hal tersebut dapat terjadi
PEMBAHASAN
Apabila senyawa ion dipukul, akan terjadi pergeseran posisi ion positif dan negatif,
dari yang semula berselang-seling menjadi berhadapan langsung. Hal ini
menyebabkan ion positif bertemu muka dengan ion positif dan terjadi gaya tolak-
menolak. Hal ini yang menyebabkan senyawa ion bersifat rapuh. Sedangkan dalam
logam terjadi karena lautan elektron pada kristal logam memegang erat ion-ion pada
logam sehingga bila dipukul atau ditempa, logam tidak akan pecah atau tercerai
berai, tetapi akan bergeser.
Saran Artikel : pembahasan fisika erlangga kelas 10
Latihan 3.5 Materi Ikatan Kimia
SOAL NO 1
Di antara molekul-molekul berikut ini, manakah yang ikatannya polar dan yang
ikatannya non-polar?
a. CCl4
b. Br2
c. F2
d.PCl3
PEMBAHASAN
a. Non polar
b. Non polar
c. Non polar
d. Polar
SOAL NO 2
Ramalkan bentuk molekul dari
a. SF6
b. SiCl4
c. H2S
d. PCl5
PEMBAHASAN
a. 16S : 2 8 6
A = 1 (Jumlah atom pusat)
B = 6 (Jumlah atom F/ PEI)
Sehingga termasuk kelompok molekul AB6 (Oktahedral)
SOAL NO 3
Berdasarkan harga keelektronegatifan dan bentuk molekulnya, tentukan apakah
molekul-molekul berikut bersifat
a. CH4
b. CO2
c. PCl5
d. SF6
PEMBAHASAN
a.Non polar karena bentuk molekulnya simetris (tidak ada PEB)
b.Non polar karena bentuk molekulnya simetris (tidak ada PEB)
c.Non polar karena bentuk molekulnya simetris (tidak ada PEB)
d.Non polar karena bentuk molekulnya simetris (tidak ada PEB)
SOAL NO 4
Apa yang dimaksud dengan gaya van der Waals?
PEMBAHASAN
Gaya antar molekul yang terjadi pada antar molekul kovalen yang bekerja untuk
mengikat molekul-molekul tersebut dalam satu kesatuan
SOAL NO 5
Hal apa saja yang menunjukkan adanya gaya antar-molekul? Jelaskan
PEMBAHASAN
Titik didih dan titik lebur. Jika gaya antar molekulnya kuat maka titik didih/titik
leburnya akan tinggi begitu pula sebaliknya leburnya akan tinggi begitu pula sebaliknya
SOAL NO 6
Mengapa suatu gas bila diturunkan suhunya pada suatu saat akan mencair dan
akhirnya memadat? Jelaskan.
PEMBAHASAN
Jika diturunkan suhunya maka jarak antar molekul menjadi sangat dekat. Akibatnya,
gaya antar molekul menjadi sangat kuat sehingga dapat menyebabkan molekul-
molekul gas berubah menjadi zat cair dan menjadi zat padat jika terus didinginkan
SOAL NO 7
Jelaskan manakah yang titik didih dan titik leburnya lebih tinggi: etanol (C2H5OH )
atau dimetil eter CH3 - OC - H3 Jelaskan alasannya
PEMBAHASAN
Pada etanol terdapat ikatan antar molekul yaitu ikatan hidrogen yang sangat kuat
dibandingkan pada dimetil eter terjadi gaya antar molekul gaya van der Waals yang
lebih lemah dibanding ikatan Hidrogen sehingga etanol akan memiliki titik didih
yang lebih tinggi dibanding dimetil eter
SOAL NO 8
Faktor apa saja yang berpengaruh terhadap kekuatan gaya van der Waals?
PEMBAHASAN
a. Ukuran molekul
Semakin besar ukuran molekul semakin besar Mr sehingga titik didih dan
titik leburnya makin tinggi
b. Bentuk molekul
Semakin dekat jarak antar molekul semakin kuat gaya antar molekulnya
sehingga titik didih dan titik leburnya makin besar
SOAL NO 9
Apa yang dimaksud gaya dispersi dan apa penyebabnya? Jelaskan
PEMBAHASAN
Gaya tarik antar molekul yang terjadi antar molekul non polar. Timbul karena
adanya dipol sesaat atau sementara
SOAL NO 10
Mengapa pada senyawa hidrokarbon berlaku jika rantai karbonnya makin panjang
titik didihnya makin tinggi? Jelaskan.
PEMBAHASAN
Semakin panjang rantai karbonnya semakin banyak tempat molekul tersebut saling
tarik menarik sehingga ikatannya makin kuat yang menyebabkan titik didihnya
makin tinggi





















No comments:
Post a Comment